

特发性肺纤维化(IPF)是一种致命的肺部疾病,其特征是细胞因子失调驱动的ECM过度沉积和肌成纤维细胞积累。本篇文献的研究确定了粒细胞集落刺激因子3(CSF3)是IPF进展的关键介质。在IPF患者的肺组织中CSF3 表达升高,重组CSF3促进肺成纤维细胞的肌纤维化,而CSF3缺陷小鼠则免受博来霉素诱导的肺纤维化的影响。用新型CSF3中和抗体治疗通过抑制肌成纤维细胞分化和减少ECM沉积,显著抑制了IPF小鼠的纤维化。本篇文章中,研究者证明了CSF3和TGF-β之间的相互调节关系。

2025年10月2日,以韩国 FNCT BIOTECH 的 Young Woo Jin、Min-Jung Kim、Su-Jae Lee 为共同通讯作者,联合汉阳大学、仁荷大学等机构的 Seungmo Kim、Yongjoong Kim 等研究者组成的团队,在《Signal Transduction and Targeted Therapy》上发表了名为“Colony-stimulating factor 3 as a key mediator in the progression of idiopathic pulmonary fibrosis: a novel therapeutic target”的研究论文。该研究表明CSF3是IPF进展的关键介质,其通过 CSF3R/STAT3 信号轴与 TGF-β 形成正反馈环驱动肌成纤维细胞活化及细胞外基质沉积,而 CSF3 中和抗体可选择性抑制过度 TGF-β 信号、逆转纤维化且维持生理稳态,为 IPF 提供了新型治疗靶点。
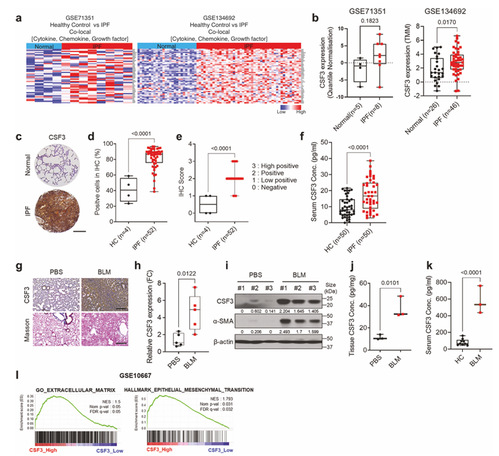
1.CSF3 在肺纤维化中高表达且与病理进程相关
为了明确 CSF3 在IPF中的表达情况及是否与纤维化病理进程相关,作者分析了 IPF 患者的公共基因数据集(GSE134692、GSE71351)以筛选差异表达的细胞因子,对 IPF 患者肺组织芯片进行免疫组化(IHC)染色检测 CSF3 蛋白表达,用 ELISA 法测定 IPF 患者与健康人血清中 CSF3 浓度,构建博来霉素(BLM)诱导的 IPF 小鼠模型并检测肺组织中 CSF3 及纤维化标志物表达,同时进行基因集富集分析(GSEA)关联 CSF3 与纤维化相关通路。得出的结论是 IPF 患者肺组织和血清中 CSF3 表达显著高于健康对照,BLM 诱导的 IPF 小鼠肺组织 CSF3 也明显升高,CSF3 表达与细胞外基质(ECM)重塑、上皮 - 间充质转化(EMT)等纤维化关键进程正相关,且 IPF 患者及模型小鼠肺组织中 CSF3 受体(CSF3R)同步高表达,提示 CSF3 信号通路在肺纤维化中被激活。
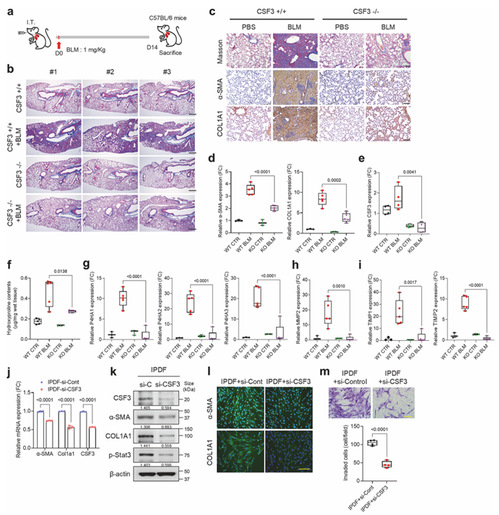
2.CSF3 敲除(KO)可减轻肺纤维化进展
为了验证 CSF3 是否为肺纤维化进展的必需因子,作者构建了 CSF3 敲除(CSF3⁻/⁻)小鼠与野生型(WT)小鼠,经气管内注射 BLM 诱导肺纤维化,对两组小鼠肺组织进行 Masson 三色染色、α-SMA 和 COL1A1 免疫组化染色,用 qRT-PCR、Western blot 检测纤维化标志物(α-SMA、COL1A1)及胶原合成相关基因(P4HA1/2/3)、ECM 降解相关基因(MMP2、TIMP1/2)表达,测定肺组织羟脯氨酸含量,同时对 IPF 患者来源成纤维细胞(IPDF)进行 CSF3 敲低(si-CSF3),检测纤维化标志物表达及细胞侵袭能力。得出的结论是 CSF3 敲除可显著减轻 BLM 诱导的小鼠肺纤维化,其表现为纤维化面积缩小、纤维化标志物表达降低、羟脯氨酸含量无升高、ECM 降解平衡紊乱改善,IPDF 敲低 CSF3 后纤维化表型减弱、细胞侵袭能力下降,证实 CSF3 是肺纤维化进展的必需因子。
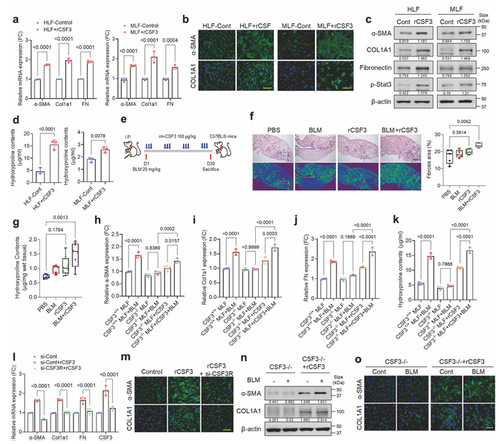
3. CSF3 通过 CSF3R/STAT3 信号轴诱导肺纤维化
为了阐明 CSF3 驱动肺纤维化的分子信号通路,作者用不同浓度重组 CSF3(rCSF3)处理人肺成纤维细胞(HLF)和小鼠原代肺成纤维细胞(MLF),对 HLF 进行 CSF3R 敲低(si-CSF3R)后再用 rCSF3 处理,用 STAT3 抑制剂干预 rCSF3 处理的成纤维细胞,构建 BLM+rCSF3 联合处理的小鼠模型检测肺组织纤维化程度,同时对 CSF3⁻/⁻小鼠来源的 MLF 进行 rCSF3 补充处理并检测纤维化标志物。得出的结论是 rCSF3 可剂量依赖性上调成纤维细胞中 α-SMA、COL1A1 等纤维化标志物及磷酸化 STAT3(p-STAT3)水平,敲低 CSF3R 或抑制 STAT3 可完全阻断 rCSF3 的促纤维化效应,CSF3⁻/⁻小鼠补充 rCSF3 后纤维化表型恢复,证实 CSF3 通过 CSF3R/STAT3 信号轴驱动肺纤维化。
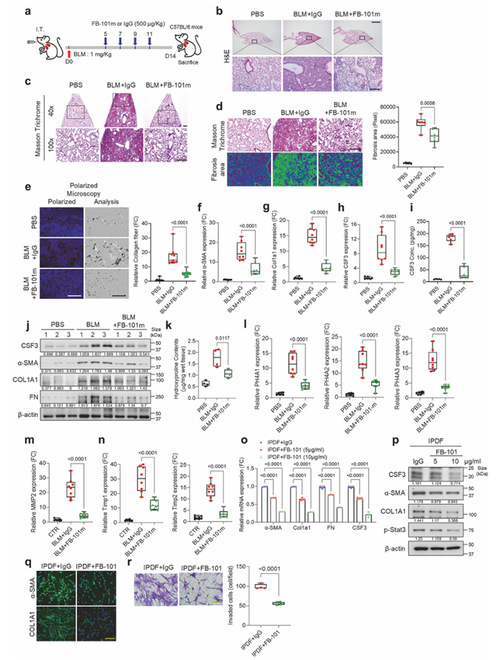
4.CSF3 中和抗体 FB-101 在肺纤维化模型中显效
为了验证 CSF3 中和抗体 FB-101 对肺纤维化的治疗效果,作者分别采用气管内和腹腔内给药方式,构建了 BLM 诱导的 IPF 小鼠模型,后分别在BLM 诱导后 5 天进行治疗性给药和在BLM 诱导后 1 天进行预防性给药,向小鼠腹腔注射 FB-101 或对照 IgG,对小鼠肺组织进行 H&E、Masson 三色、天狼星红染色以量化纤维化面积,用 qRT-PCR、Western blot、ELISA 检测纤维化标志物、CSF3 水平及胶原合成相关基因(P4HA1/2/3)、ECM 降解相关基因(MMP2、TIMP1/2)表达,同时用 FB-101 处理 IPDF 和 BLM 诱导的小鼠肺成纤维细胞(BLM-MLF),检测细胞纤维化表型、p-STAT3 水平及细胞侵袭能力。得出的结论是 FB-101 可显著减轻 BLM 诱导的小鼠肺纤维化,减少胶原沉积和肺泡壁破坏,降低纤维化标志物及羟脯氨酸含量,体外实验中 FB-101 可抑制 IPDF 中 CSF3 表达、STAT3 激活及细胞侵袭,且在 10μg/ml 浓度以上疗效达峰,证实 FB-101 具有潜在治疗肺纤维化的价值。
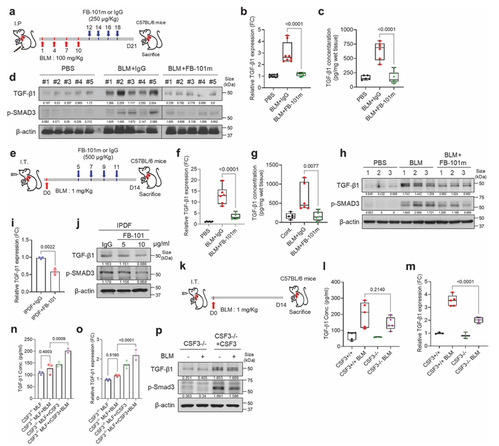
5.CSF3 是 TGF-β 的上游调控因子,形成正反馈环
为了明确 CSF3 与纤维化核心因子 TGF-β 的调控关系,作者用 FB-101 处理 BLM 诱导的 IPF 小鼠,检测肺组织中 TGF-β1 的 mRNA、蛋白表达及分泌水平,同时检测 p-SMAD3 水平,后对 CSF3⁻/⁻小鼠和 WT 小鼠进行 BLM 处理,对比肺组织 TGF-β1 表达及分泌,用 rCSF3 处理 HLF 检测 TGF-β1 及下游因子(IL-11、CTGF)表达,对 HLF 进行 TGF-βRII 敲低后再用 rCSF3 处理检测纤维化标志物,用重组 TGF-β1 处理 HLF 检测 CSF3 表达。得出的结论是 CSF3 是 TGF-β1 的上游调控因子,FB-101 处理或 CSF3 敲除可选择性降低 IPF 病理状态下过度的 TGF-β1 表达及 SMAD3 磷酸化,且不影响 TGF-β1 的基础生理水平,rCSF3 可诱导 TGF-β1 及其下游因子表达,而 TGF-β1 反过来可促进 CSF3表达,二者形成正反馈环,共同放大促纤维化信号。
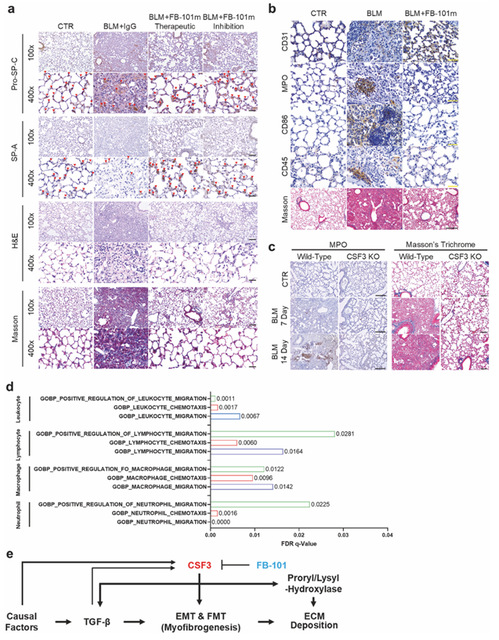
6.CSF3 中和可恢复 AT2 细胞功能并调节免疫细胞招募
为了探究 CSF3 中和后对肺组织修复及免疫细胞招募的影响,完善 CSF3 驱动肺纤维化的整体机制,作者用 FB-101 治疗 BLM 诱导的 IPF 小鼠,通过免疫荧光染色检测 II 型肺泡上皮细胞(AT2)标志物(pro-SP-C、SP-A)表达,用免疫组化染色检测肺组织中血管内皮细胞标志物(CD31)、中性粒细胞标志物(MPO)、巨噬细胞标志物(CD86)及泛白细胞标志物(CD45),对比 CSF3⁺/⁺和 CSF3⁻/⁻小鼠 BLM 处理后中性粒细胞浸润情况,同时进行 GSEA 分析关联 CSF3 表达与免疫细胞迁移相关基因。得出的结论是 FB-101 可恢复 BLM 诱导减少的 AT2 细胞数量,改善肺组织血管形态,同时显著减少中性粒细胞、巨噬细胞等免疫细胞的异常招募和浸润,GSEA 证实 CSF3 高表达与免疫细胞迁移相关基因正相关,综上 CSF3 通过激活 CSF3R/STAT3 信号轴及与 TGF-β 形成正反馈环驱动肺纤维化,靶向 CSF3 可逆转纤维化进程、修复肺组织损伤。
综上,上述研究通过多维度实验系统证实,CSF3是IPF进展的关键驱动介质 —— 其在 IPF 患者及 BLM 诱导的纤维化模型中均高表达,且与 ECM 重塑、EMT 等病理进程密切相关。CSF3 通过激活 CSF3R/STAT3 信号轴,并与 TGF-β 形成正反馈环放大促纤维化信号,是纤维化进展的必需因子。无论是基因敲除 CSF3 还是使用中和抗体 FB-101,均能有效减轻肺纤维化、降低胶原沉积、抑制成纤维细胞活化,且 FB-101 可在体内外展现显著治疗效果。同时,CSF3 中和还能恢复 AT2 细胞功能、改善肺组织血管形态、减少免疫细胞异常浸润,实现肺组织修复与免疫调节。这些发现共同明确了 CSF3 在 IPF 发病机制中的核心地位,为 IPF 提供了兼具诊断潜力与治疗价值的新型靶点,也为 FB-101 等 CSF3 靶向药物的临床转化奠定了坚实基础。
原文链接:
https://www.nature.com/articles/s41392-025-02421-6