

特发性肺纤维化(IPF)是一种慢性进行性间质性肺疾病,核心特征为转化生长因子 -β(TGF-β)介导的细胞转分化、细胞外基质(ECM)过度沉积,最终导致肺功能进行性下降,目前临床治疗手段有限且疗效不佳。
TGF-β 与 ECM 沉积构成的 “生化-机械” 调控轴是 IPF 进展的关键:TGF-β 驱动促纤维化信号通路,ECM 过度沉积引发的硬度升高进一步破坏肺部机械微环境,二者相互作用推动疾病持续进展,但如何精准阻断该调控轴仍是未解决的治疗难题。

近日,Xian Wu Cheng, Lei Xing, and Hu-Lin Jiang 团队在 Advanced Science 发表题为 “Pulmonary-Targeted Nanoparticles Interrupt the Malignant Mechanical and Biochemical Signaling Crosstalk for Idiopathic Pulmonary Fibrosis Therapy” 的研究论文。研究团队开发了一种吸入性肺靶向纳米颗粒(VB-RT NPs),这种纳米颗粒通过共载药物并双重修饰,可同时阻断 IPF 中的机械和生化信号恶性串扰,在体外和体内均展现出显著抗纤维化效果,为 IPF 治疗提供了创新策略。
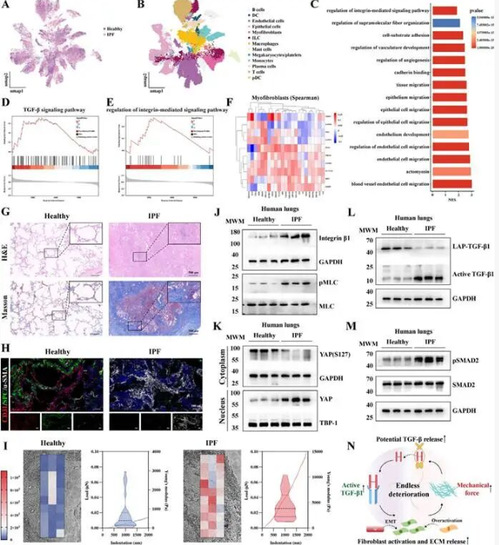
1、单细胞测序与多技术验证揭示 IPF 肺组织机械-生化信号恶性交互。
为解析 IPF 的核心致病机制,研究团队整合单细胞 RNA 测序、组织染色、原子力显微镜(AFM)等技术,对比健康与 IPF 患者肺组织:发现 IPF 肺组织中 TGF-β 信号与整合素介导的机械信号通路显著富集,胶原沉积增加导致肺组织刚度升高 6.4 倍;肌成纤维细胞激活、内皮-间质转化(EndMT)增强,伴随 YAP 核转位异常和 TGF-β latent 复合物激活,证实 IPF 中存在 “机械力激活 TGF-β→促进 ECM 沉积→组织刚度增加→进一步激活机械信号” 的恶性循环,为靶向信号串扰提供理论基础。
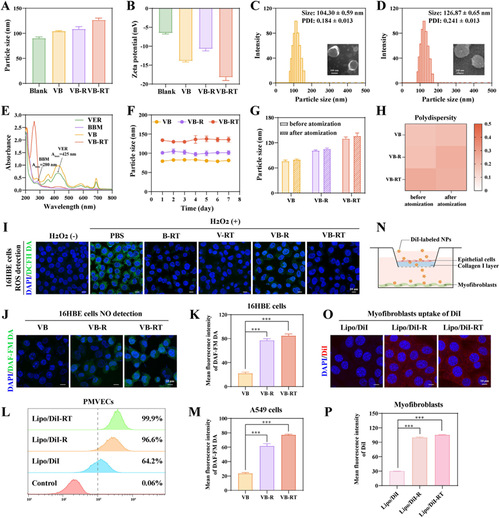
2、VB-RT NPs 的制备表征与多功能性验证。
为实现靶向治疗,研究构建了共载维替泊芬(VER)和小檗胺(BBM)、表面修饰单宁酸(TA)和 L-精氨酸的脂质纳米颗粒(VB-RT NPs):表征显示其粒径 126.87±0.65 nm,稳定性良好,雾化后结构不变;TA 修饰可高效清除 ROS 并增强肺靶向性,L-精氨酸诱导 NO 生成激活 MMPs,促进 ECM 降解和 NPs 深层穿透;体外实验证实 NPs 能被成纤维细胞、内皮细胞高效摄取,且 VER 与 BBM 存在协同抗纤维化作用。
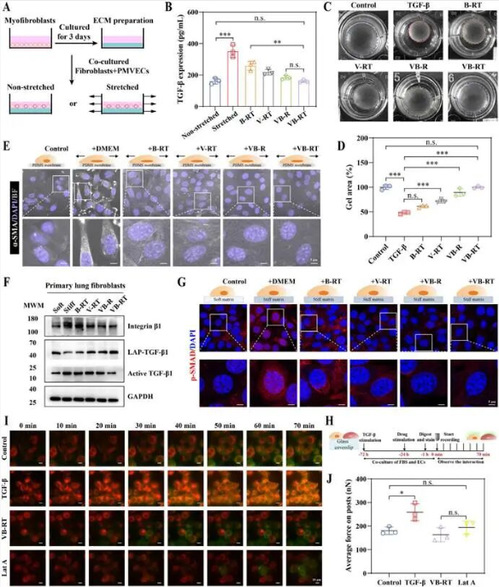
3、VB-RT NPs 体外阻断成纤维细胞机械-生化信号交互。
为验证 NPs 对成纤维细胞的作用,开展体外机制实验:在拉伸培养体系中,VB-RT NPs 显著抑制机械力诱导的 latent TGF-β 激活,恢复至基线水平;胶原凝胶收缩实验显示其有效降低成纤维细胞收缩力, cyclic 拉伸条件下抑制 α-SMA 表达;在刚性基质上,NPs 下调整合素 β1 表达,减少 SMAD 核转位和 YAP 激活,阻断成纤维细胞中机械-生化信号的恶性反馈,抑制其向肌成纤维细胞分化。
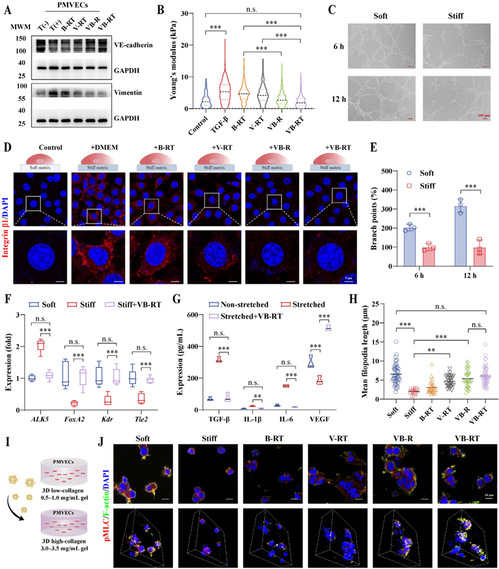
4、VB-RT NPs 体外改善内皮细胞功能并阻断 EndMT。
针对 IPF 中内皮细胞异常,研究开展内皮细胞相关体外实验:TGF-β 诱导下,VB-RT NPs 显著抑制 EndMT(上调 VE-cadherin、下调 Vimentin),降低内皮细胞刚度;在刚性基质上,NPs 促进血管管腔形成和丝状伪足延伸,恢复 Tie2、Kdr 等血管相关基因表达;同时减少机械拉伸诱导的 TGF-β、IL-1β 等促纤维化细胞因子分泌,恢复 VEGF 水平,维持内皮细胞正常功能。
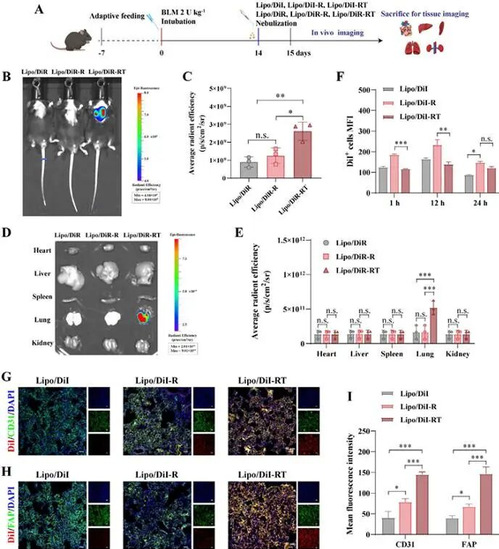
5、VB-RT NPs 在纤维化小鼠肺中实现高效靶向与组织穿透
为评估 NPs 的体内靶向性,在 BLM 诱导纤维化小鼠中进行生物分布研究:雾化给药后,VB-RT NPs 在肺组织中荧光强度显著高于未修饰或单修饰纳米颗粒,且在心脏、肝脏等器官分布少;共定位实验显示 NPs 与 CD31⁺内皮细胞、FAP⁺肌成纤维细胞高度结合,精准富集于纤维化病变区域;同时L-精氨酸促进 NPs 穿透气道黏液和致密 ECM,实现深层组织穿透,为后续治疗奠定递送基础。
6、VB-RT NPs 体内调节生化信号并显著缓解肺纤维化。
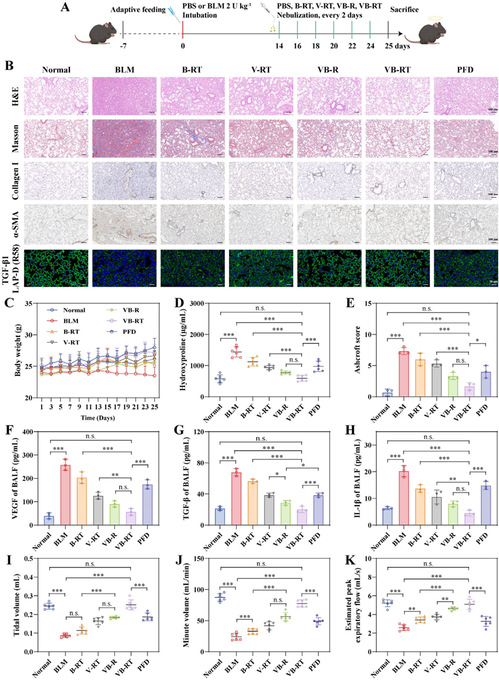
在 BLM 诱导纤维化小鼠模型中,评估 VB-RT NPs 的治疗效果:经雾化治疗后,小鼠肺组织肺泡结构破坏减轻,胶原沉积显著减少,α-SMA 和 Collagen I 表达下调;体重恢复至健康水平,肺组织羟脯氨酸含量降低,促纤维化细胞因子(TGF-β、IL-1β)减少,肺功能(潮气量、分钟通气量等)显著改善;且无肝肾功能损伤,安全性优于临床药物吡非尼酮(PFD)。
7、在肺纤维化小鼠中VB-RT NPs 调控机械信号并改善机械微环境。
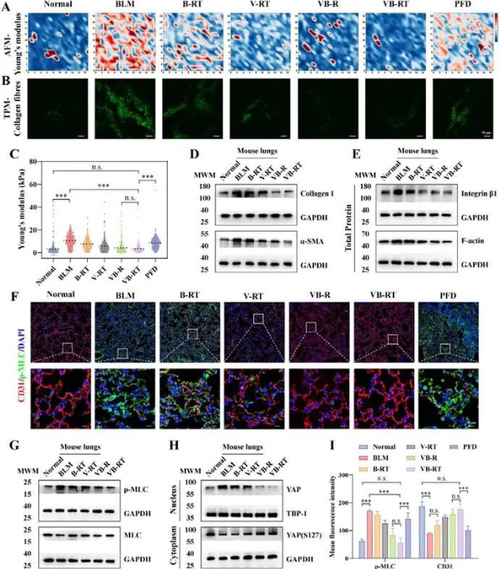
为验证 NPs 对机械信号的调节作用,检测纤维化小鼠肺组织力学特性:VB-RT NPs 治疗后,肺组织刚度从 10.56 kPa 降至 3.45 kPa,接近健康肺组织(3.25 kPa);下调整合素 β1、F-actin 和 pMLC 表达,恢复 CD31⁺血管结构;抑制 YAP 核转位,阻断机械传导通路激活,重塑肺组织机械微环境,打破机械-生化信号的恶性循环。
上述研究证实,IPF 中机械-生化信号的恶性交互是疾病进展的核心驱动力,而 VB-RT NPS 通过肺靶向递送、ROS 清除、ECM 穿透三重优势,同时阻断生化信号(TGF-β/SMAD)和机械信号(YAP / 整合素),实现了对 IPF 的高效精准治疗。该策略为 IPF 的机制研究和临床转化提供了全新思路,具有重要的应用前景。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202512658