

组织炎症和纤维化导致器官功能障碍,直接影响的临床结局。心脏纤维化通常出现在心肌梗死(MI)患者以及缺血性和非缺血性心肌病(ICM和NICM)患者中。然而目前并没有针对直接针对心脏纤维化的治疗策略。许多研究已经在小鼠心脏损伤模型中描述了各类成纤维细胞亚型。然而,在人类心脏中负责纤维化的确切成纤维细胞群以及协调其出现和成熟的机制尚不清楚。此外,目前尚不清楚在众多可用的临床前体外和体内模型中,哪一种最能概括人类心脏成纤维细胞亚型。

2024年10月23日,来自华盛顿大学的Kory J. Lavine课题组在Nature杂志发表研究《Targeting immune–fibroblast cell communication in heart failure》,该研究通过单细胞基因表达、表位映射和染色质可及性分析,对来自健康供体、急性梗死和慢性衰竭的人心脏进行了多组学分析。研究结果表明,与疾病相关的成纤维细胞轨迹分化为两个不同的群体, C-C 化学趋化因子受体 2 (CCR2) 巨噬细胞和成纤维细胞之间的相互作用,通过白细胞介素-1β (IL-1β) 信号传导驱动了在空间定义的微环境中 FAP/POSTN 成纤维细胞的出现。删除成纤维细胞上的 IL-1 受体和 CCR2+ 单核细胞和巨噬细胞上的 IL-1β 配体,或使用单克隆抗体抑制 IL-1β 信号传导,减轻心肌纤维化,改善心脏功能。一、心力衰竭的多组学图谱。
作者对6名健康志愿者、4名急性心肌梗死(AMI)患者(心肌梗死后不到3个月)、6名缺血性心肌病(ICM)患者(心肌梗死后超过3个月)和6名非缺血性心肌病(NICM)(特发性扩张型心肌病)患者的左心室标本进行了CITE-seq测序(图1A)。
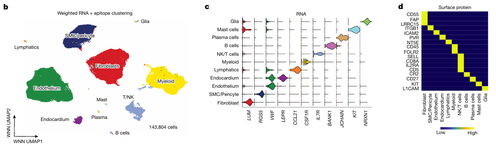
鉴定出11种不同的细胞类型(图1B),具有典型基因(图1C)和蛋白质(图1D)特征。
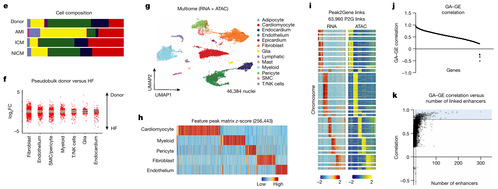
AMI后髓系细胞和T细胞扩增,其中髓系细胞在第一周内扩增最大(图1E)。心力衰竭(AMI、ICM、NICM)的成纤维细胞、内皮细胞、平滑肌细胞、周细胞和髓系细胞和健康人群的存在很大差异(图1F)。进一步对供体、AMI、ICM和NICM等23个样本进行了scRNA-seq和snATAC-seq,使用RNA水平marker基因表达确定主要细胞类型(图1G),使用MACS2识别主要细胞类型之间的差异可及性位点(图1H)。ArchR计算每个细胞类型中的可及性峰和基因表达的联系(图1I)。利用RNA和ATAC数据计算每个细胞核中基因表达和可及性(GE-GA)之间的Pearson 相关系数(图1J),并使用Peak2Gene 链接矩阵计算与每个基因相连的增强子数量。为了识别染色质预测基因 (GPCs),作者筛选出 GE-GA 相关性得分处于前 10%的基因,并检查它们是否与至少十个顺式调控元件 (CREs) 相连(图1K)。有趣的是,许多由转录因子组成的候选GPCs与动态调控元件相关联,这突出了多组学测序鉴定细胞类型特异性基因调控网络的潜力。
二、心力衰竭中成纤维细胞状态。
CITE-seq 数据的无偏聚类确定了 13 种不同的成纤维细胞细胞状态 (图 2A),分别以 Pl16/CCDC80/FBLN1 (F1, 基础状态)、ACTA2/TAGLN (F2, 肌成纤维细胞)、CCL2/THBS1 (F3)、APOE/AGT (F4)、DLK1/GPX3 (F5)、PTGDS/GPC3 (F6)、APOD/IGFBP5 (F7)、GDF15/ATF5 (F8)、FAP/POSTN (F9)、ISG15/MX1 (F10)、PLA2G2A (F11)、PCOLCE2/MFAP5 (F12) 和 PRG4/CXCL14 (F13) 为特征 (图 2B)。健康心脏中含有最多的 F4 (APOE/AGT) 和 F5 (DLK1/GPX3) 成纤维细胞。急性心肌梗死 (AMI) 和慢性心力衰竭 (HF) 心脏中含有最多的 F9 (FAP/POSTN) 和 F2 (肌成纤维细胞) 纤维细胞 (图 2B)。F9 成纤维细胞在 RNA 和细胞表面蛋白水平上富含 FAP,并且共表达 POSTN (图 2C)。左心室切片中 FAP 的免疫染色显示,健康供体中表达量最小,慢性 ICM 和 NICM 中表达量中等,而在 AMI 后表达量显著升高 (图 2D)。FAP/POSTN 转录组特征在 MI 后早期达到峰值,在 3 个月期间下降,之后持续慢性升高 (图 2E)。人类 MI 的空间转录组数据发现 FAP 表达在 MI 后急性期最为显著,并在后期逐渐减弱 (图 2E)。
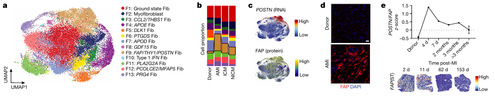
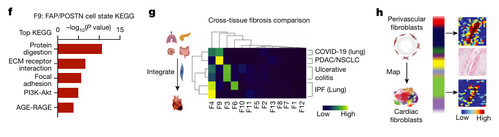
KEGG通路分析使用 F9 标记基因显示富含细胞外基质重塑、细胞间粘附、蛋白质消化、PI3K-Akt 信号传导和 AGE-RAGE 通路 (图 2F)。此外疾病特征基因映射到 F9 成纤维细胞,而健康供体特征则定位于 F5、F7 和 F11 成纤维细胞中。因此 F9 成纤维细胞被视为潜在的致病细胞状态。
为了评估 HF 中的心脏成纤维细胞与其他纤维化疾病中的成纤维细胞之间的差异,作者将已发表的数据集与自己的人类心脏成纤维细胞数据集进行了整合。其中F9 成纤维细胞与癌症相关成纤维细胞最为相似,而 F4 成纤维细胞映射到特发性肺纤维化成纤维细胞 (图 2G)。
空间转录组数据确定了梗死区(F2、F8、F9)、边缘区(F5、F6、F7、F10、F13)和远端区(F11、F12)的成纤维细胞分布。F2成纤维细胞与血管周围细胞(周细胞)相关,而F9成纤维细胞与髓样细胞和F4成纤维细胞相关。作者将人类冠状动脉成纤维细胞群体与人类心脏成纤维细胞进行了对比,发现F2和F11成纤维细胞确实与冠状动脉外膜的映射最大,血管周围区域则未见F9成纤维细胞(图2H)。
三、心肌成纤维细胞谱系。
使用 scVelo 和动态建模推断成纤维细胞趋向于 F2、F4 和 F9状态分化的方向性(图 2I)。Palantir 也预测F2、F4 和 F9 为具有低熵值的终端状态(图 2J)。
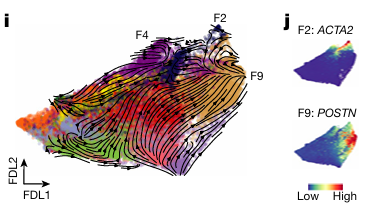
供体成纤维细胞特征在伪时间早期最为丰富,而疾病特征在每个轨迹上随着伪时间的推移而增加。FAP 表达在 F9 谱系中逐渐增加。值得注意的是,F2、F4 和 F9 成纤维细胞特异性地随着伪时间的推移而增加。这些数据表明,FAP/POSTN(F9)成纤维细胞与肌成纤维细胞(F2)和其他预测的终端成纤维细胞状态不同。使用 RNAscope 和免疫荧光分别针对 POSTN 和 ACTA2,在人类梗死组织中验证了 F2 和 F9 成纤维细胞群是不同的细胞类型(图 2K)。同时 Fap遗传谱系追踪小鼠也确定了Fap + 细胞对 POSTN 谱系有贡献,但对 ACTA2 肌成纤维细胞谱系没有贡献(图 2N)。
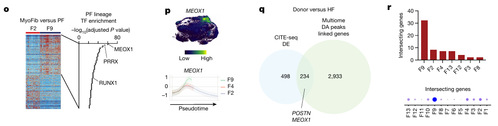
转录因子富集确定 MEOX1 为驱动 F9 谱系的最主要转录因子(图 2O)。CellOracle 构建的基因调控网络确定了 RUNX1 周围的富集连接。MEOX1 在 F9 谱系中与 RUNX1 和 POSTN 共表达,但与 ACTA2 表达无关,也不在肌成纤维细胞轨迹或状态(F2)中表达(图 2P)。将CITE-seq和snRNA-seq以及snATAC-seq差异分析结果整合后发现了 234 个重叠基因(图 2Q),包括 POSTN、MEOX1 和 RUNX1。其中F9 成纤维细胞具有最多的交集基因,并且相对于其他成纤维细胞状态(包括肌成纤维细胞 F2)表现出该基因集的显著富集(图 2R)。总的来说, FAP/POSTN(F9)成纤维细胞受 RUNX1 和 MEOX1 调控。
四、实验性心肌纤维化模型。
为了解决现有实验系统是否适合研究心肌成纤维细胞的问题,作者检查了多种心脏损伤模型以及人类成纤维细胞培养系统。
作者将传统的鼠左前降支(LAD)冠状动脉结扎引发的心肌梗死模型的scRNA数据集映射到当前自己的成纤维细胞图谱上,映射分数在除了 F5、F6 和 F7 成纤维细胞的大多数细胞状态中都很强(图 3A)。MI 后F9 成纤维细胞显著增加,在 MI 后第 7 天达到峰值,并在 MI 后第 28 天与假手术组相比仍然升高(图3B)。
接下来,作者对小鼠主动脉弓缩窄模型的成纤维细胞进行了标签转移,将其映射到人类成纤维细胞(图 3C)。有趣的是, JQ1 治疗(导致左心室收缩功能改善和纤维化消除)与 F9 成纤维细胞的丢失相关。在不使用 JQ1治疗后,F9 成纤维细胞重新出现,这表明这是一种可逆效应。
作者随后检查了血管紧张素 II/去氧肾上腺素 (AngII/PE) 输注的心脏纤维化实验模型。与小鼠 MI 和 TAC 模型一致,作者发现损伤后 F9 细胞数量增加,除了 F5 和 F6 细胞外,大多数成纤维细胞群体的映射评分都很高(图 3C-E)。
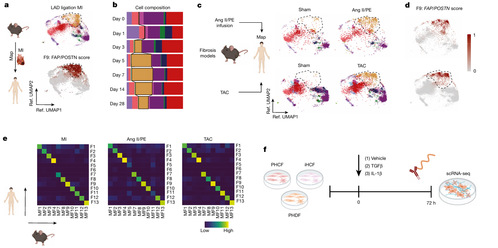
为了检验常用的人类培养成纤维细胞系统是否能够重现人类心脏成纤维细胞状态,作者测试了三种不同的成纤维细胞细胞制备:原代人心脏成纤维细胞(PHCFs)、原代人真皮成纤维细胞(PHDFs)和永生化人心脏成纤维细胞(iHCFs)。每种成纤维细胞系都经过 72 小时的对照溶剂、转化生长因子-β(TGFβ)或 IL-1β处理,并进行了 scRNA-seq 分析。分别用哈希标签标记并混合,以最大限度地减少任何潜在的批次效应(图 3F)。
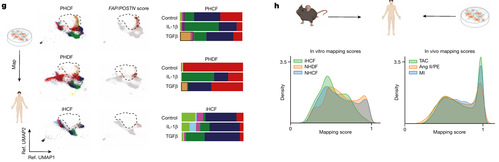
接下来,作者将培养成纤维细胞数据映射到作者的人类成纤维细胞数据集上。所有培养细胞系都不具备良好的再现人类心脏成纤维细胞状态的能力。PHCFs 和 PHDFs 与 iHCFs 相比,存在更广泛的细胞状态多样性。TGFβ处理导致 PHCF 和 PHDF 模型中的 F9 成纤维细胞适度扩张;然而,这些细胞在人类 CITE-seq 数据集中的映射表现不佳(图 3G)。总体而言,心脏损伤小鼠模型与人类成纤维细胞相比,转录相似性显著更高(图 3H)。这些数据表明,小鼠心脏损伤模型是探索 FAP/POSTN(F9)成纤维细胞出现和心脏纤维化相关机制的合理实验模型。
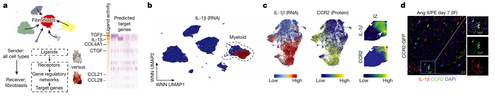
五、纤维化生态位中的炎症信号。
NicheNet确定TGFβ和 IL-1β为最强的预测信号(图 4A)。其中IL-1β在髓系细胞(图 4B)中特异性表达,更具体而言,是在 CCR2+ 单核细胞和巨噬细胞以及经典树突状细胞(DC2s)中表达(图 4B,C),这些细胞在梗死区域共定位(图 4C)。在 Ang II/PE 灌注模型中,IL-1β表达和 CCR2 + 单核细胞和巨噬细胞一致(图 4D)。
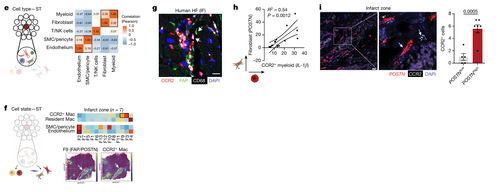
作者将每个spot解卷积为其相对细胞组成,并计算了细胞间相关性,发现成纤维细胞与髓系细胞和 T 细胞强烈共定位,形成一个免疫-成纤维细胞生态位。平滑肌细胞、周细胞和内皮细胞在独特的血管周围生态位中共定位(图 4E)。CCR2 + 巨噬细胞与 F9 成纤维细胞共定位,而驻留巨噬细胞与 F4 成纤维细胞共定位(图 4F)。值得注意的是,F2 成纤维细胞与 SMCs、周细胞和内皮层共定位,而不与 CCR2 + 巨噬细胞共定位(图 4F)。免疫荧光显示 FAP + 成纤维细胞与 CCR2 + 巨噬细胞在衰竭的左心室中的共定位(图 4G)。巨噬细胞 IL-1β表达与成纤维细胞 POSTN 表达之间存在强烈相关性(图 4H)。POSTN 和 CCR2 的 RNAscope 检测显示,与 POSTN + 细胞数量较少的区域相比,在 POSTN + 细胞数量较多的区域中 CCR2 + 细胞更多(图 4I)。
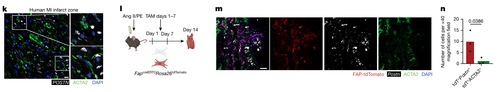
为了确定 IL-1β信号传导对心肌纤维化的必要性,作者生成了成纤维细胞中缺乏IL-1 受体(IL-1R)的小鼠(IL-1R flox/flox Dermo1 Cre 小鼠)。对照组和 IL-1R flox/flox Dermo1 Cre 小鼠接受了假手术或接受了 Ang II/PE处理(图 4j)。与假手术相比,Ang II/PE 处理动物中 FAP + 成纤维细胞的比率增加。与对照小鼠相比,IL-1R flox/flox Dermo1 Cre 小鼠中 FAP + 成纤维细胞的数量更少(图 4k )。
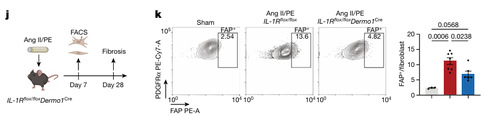
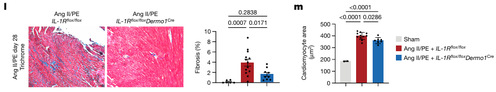
Ang II/PE 灌注导致对照组小鼠间质纤维化增加,然而Ang II/PE 处理的 IL-1Rflox/floxDermo1 Cre 小鼠三色染色减少(图 4l)。Ang II/PE 处理的对照组心肌细胞横截面积增加,然而 Ang II/PE 处理的 IL-1Rflox/floxDermo1 Cre 小鼠心肌细胞大小显著减小(图 4M)。
六、来自 CCR2 + 巨噬细胞的IL-1β驱动心脏功能障碍。
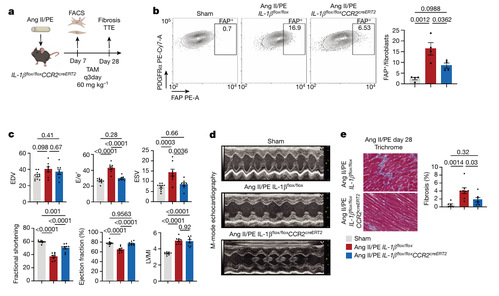
为了确定由 CCR2 + 单核细胞和巨噬细胞衍生的 IL-1β是否对心脏纤维化是必需的,作者构建了CCR2 + 单核细胞和巨噬细胞中 缺乏 IL-1β的小鼠(IL-1β flox/flox CCR2 creERT2 ) 。对照组和 IL-1β flox/flox CCR2 creERT2 鼠接受了假手术或接受了 Ang II/PE 处理(图 5A)。Ang II/PE 处理的心脏中 FAP + 成纤维细胞的比率增加。IL-1β flox/flox CCR2 creERT2 的 FAP + 成纤维细胞更少(图 5B)。与 IL-1β flox/flox 小鼠相比,IL-1β flox/flox CCR2 creERT2 小鼠左心室收缩末期容积显著降低,而分数缩短和射血分数显著改善(图 5C, D)。与 IL-1β flox/flox 小鼠相比,Ang II/PE 灌注导致 IL-1β flox/flox CCR2 creERT2 小鼠间质纤维化减少(图 5E)。
七、IL-1β驱动成纤维细胞活化。
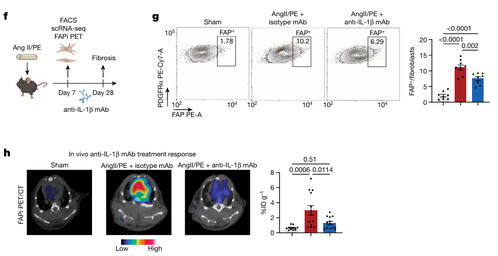
作者观察到接受抗-IL-1β单克隆抗体处理的小鼠中 FAP + 成纤维细胞的数量减少,与接受同型抗体的小鼠相比(图 5G)。Ang II/PE 处理小鼠的成纤维细胞活化, 接受抗-IL-1β单克隆抗体治疗的小鼠活化更少(图H)。
在第 7 天对经同型或抗-IL-1β单克隆抗体处理的成纤维细胞进行了单细胞 RNA 测序。作者发现存在七个转录上不同的成纤维细胞细胞状态(图 5I),并构建了抗-IL-1β单克隆抗体处理组中下调基因的签名。这个基因集主要富集在 Postn + 成纤维细胞(图 5I)。抗-IL-1β单克隆抗体治疗还降低了肌成纤维细胞标记物 Acta2 的表达。然而,Tagln 和 Sparc 没有受到显著影响(图 5J)。
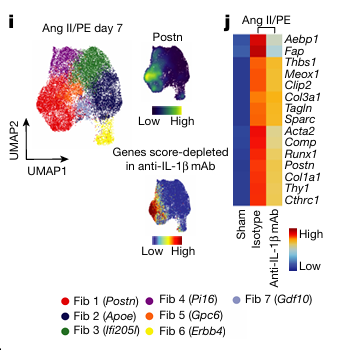
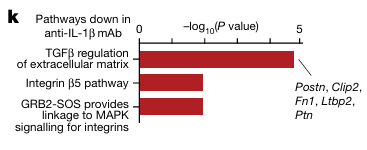
通路富集显示,抗-IL-1β单克隆抗体组中 TGFβ对细胞外基质的调节减少(图 5K)。此外,作者将小鼠数据映射到作者的人类心脏成纤维细胞数据上发现与同型对照相比,抗-IL-1β单克隆抗体组中预测的 F9 成纤维细胞数量更少。
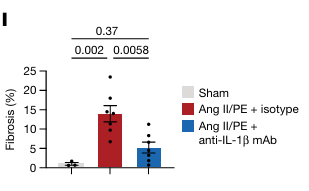
作者发现通过渗透性微泵连续 28 天给予 Ang II/PE 灌注后,抗 IL-1β单克隆抗体治疗减少了心脏纤维化(图 5L)。同时进行的研究也表明,抗 IL-1β单克隆抗体治疗改善了 TAC HF 模型中的心脏功能和减少了纤维化。
原文链接:
https://www.nature.com/articles/s41586-024-08008-5